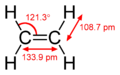Wikipedistka:Naďa Čel/Pískoviště
Slavní organičtí chemici - ACS Divize organické chemie (organicdivision.org)
Seznam chemiků – Wikipedie (wikipedia.org)
Dvojná vazba je forma kovalentní vazby, která zahrnuje čtyři vazebné elektrony. Dva atomy jsou tedy navzájem spojeny dvěma vázacími elektronovými páry. Dvojné vazby jsou bohaté na elektrony, proto jsou reaktivní v přítomnosti silného akceptoru elektronů (například halogenů). Ve strukturních vzorcích se dvojná vazba znázorňuje dvěma rovnoběžnými čarami mezi atomy.[1]
Mezi stejnými dvěma atomy je dvojná vazba obecně silnější a kratší než vazba jednoduchá. Pokud molekula obsahuje dvě nebo více dvojných vazeb, označujeme je podle polohy jako kumulované, konjugované nebo izolované.
Nejčastější dvojnou vazbu je vazba mezi dvěma atomy uhlíku v alkenech. Existuje však také mezi různými prvky. Například v karbonylové skupině mezi atomem uhlíku a atomem kyslíku (C=O), v azosloučeninách (N=N), iminech (C=N) a sulfoxidech (S=O).
- Chemical compounds with double bonds
Historie[editovat | editovat zdroj]
- Dvojné vazby zavedl v chemické notaci ruský chemik Alexander Michajlovič Butlerov (1828-1886).
- Reprezentaci dvojné vazby dvěma dvojnými čarami zavedl rakouský chemik a fyzik Johann Josef Loschmidt (1821-1895).
- Koncovky -an, -en, -in pro označení nasycených a nenasycených alkanů zavedl německý chemik August Wilhelm von Hofmann (1818-1892).
- Běžné chemické sloučeniny s dvojnou vazbou

Princip dvojné vazby[editovat | editovat zdroj]
Princip dvojné vazby se dá jednoduše vysvětlit pomocí hybridizace orbitalů. Například v ethenu má každý atom uhlíku tři sp2 orbitaly a jeden p-orbital. Tři sp2 orbitaly leží v jedné rovině se třemi 120° úhly mezi nimi. Nehybridizovaný p-orbital je kolmý k této rovině. Když se tyto dva atomy uhlíku přiblíží, jeden ze tří sp2 orbitalů na prvním uhlíku vytvoří σ vazbu s příslušným sp2 orbitalem na druhém uhlíku. Ve stejnou chvíli spolu výše zmíněné p-orbitaly vytvoří vazbu druhou (π vazbu). Kvůli maximálnímu překryvu orbitalů (silnější vazba) k sobě zůstávají p-orbitaly v rovnoběžné poloze, a proto není obecně možná rotace kolem dvojné vazby. Z této vlastnosti pramení cis- a trans- izomerie.
-
Dva sp2 orbitaly se přibližují a tvoří σ vazbu
-
Překryvem dvou pz orbitalů vzniká vazby typu π
Odkazy[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Double bond na anglické Wikipedii.
- ↑ Organic Chemistry 2nd Ed. John McMurry
Související články[editovat | editovat zdroj]
Odkazy[editovat | editovat zdroj]
Související články[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byly použity překlady textů z článků Christopher Kelk Ingold na anglické Wikipedii a Christopher Kelk Ingold na německé Wikipedii.