Nenitzescuova syntéza indolů
Nenitzescuova syntéza indolů je organická reakce sloužící k přípravě 5-hydroxyindolů z benzochinonu a esterů kyseliny β-aminokrotonové.
Reakci objevil Costin Nenițescu v roce 1929.[1] Lze ji provést u substrátů s mnoha různými substituenty, například methylovými, methoxy, ethylovými a propylovými.[2] Může probíhat v pevném skupenství na povrchu vysoce zesíťovaných polymerů.[3] Nenitzescuova syntéza indolů patří mezi významné reakce, protože indolová jádra jsou součástí molekul mnoha biologicky aktivních sloučenin, například neurotransmiterů.
Mechanismus[editovat | editovat zdroj]
Mechanismus Nenitzescuovy syntézy indolů se skládá z Michaelovy reakce následované nukleofilním atakem vazby pí v molekule enaminu a poté eliminační reakcí.[4]

Ve studii z roku 1996 zkoumal G. Allen vliv různých substituentů navázaných na molekulu použitého benzochinonu na vlastnosti produktu. Sterické efekty vyvážené těmito substituenty zároveň podpořily jeden ze dvou navrhovaných mechanismů.[2]
Vliv podmínek na reakci[editovat | editovat zdroj]
Ve studii z roku 2004 zkoumal D. Katkevica et al. vliv reakčních podmínek na Nenitzescuovu syntézu.[5] Výsledky naznačily, že reakce nejlépe probíhá ve velmi polárních rozpouštědlech, a staly se motivací k provedení kinetických studií s různými substráty, reaktanty, rozpouštědly a přídavky Lewisových kyselin a zásad. Následně byl popsán alternativní způsob syntézy s využitím katalýzy Lewisovými kyselinami.[6]
I přes vylepšení nebylo možné Nenitzescuovu syntézu kvůli nízké výtěžnosti a polymerizaci při běžných reakčních podmínkách možné použít v průmyslu. Původně se předpokládalo, že benzochinon musí být použit ve 100% přebytku, aby bylo možné reakci účinně využívat v průmyslu, ale pak bylo zjištěno, že nejvyšší účinnosti se dosahuje při 20% až 60% přebytku.[7] Nejvhodnější podmínky pro průmyslově prováděnou Nenitzescuovu syntézu jsou, pokud se benzochinon a ethyl-3-aminokrotonát použijí v poměru látkových množství 1:1,2 až 1,6 a reakční teplota je blízko pokojové. Tímto způsobem je možné efektivně vyrábět i více než 100 kg indolů.
Obměny[editovat | editovat zdroj]
K nejčastějším obměnám Nenitzescuovy reakce patří její provedení v pevné fázi.[3]
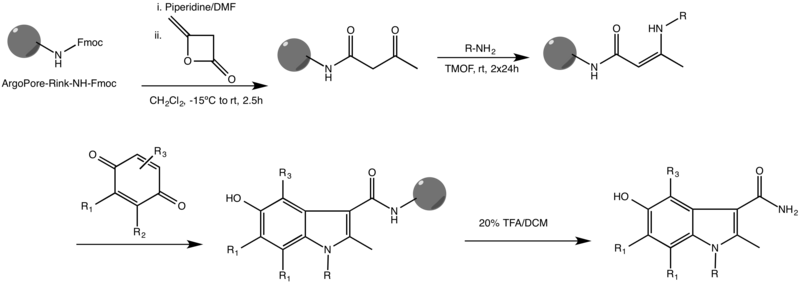
Tato reakce se provádí na vysoce zesíťovaném polymeru ArgoPore®-Rink-NH-Fmoc a funguje u mnoha různých substituentů na obou reaktantech. Byly také popsány jiné způsoby Nenitzescuovy syntézy v pevné fázi.
Jsou také známy i jiné reakce vedoucí ke stejným produktům. Patří k nim Fischerova, Moriova, Hemetsbergerova, Buchwaldova, Sundbergova, Madelungova, van Leusenova a Kanemacuova syntéza.[8]
Použití[editovat | editovat zdroj]
5-hydroxyindolové skupiny jsou součástí řady biologicky aktivních molekul, jako například neurotrasmiteru serotoninu, nesteroidního antiflogistika indometacinu a L-761,066, inhibitoru COX-2.[3]
Odkazy[editovat | editovat zdroj]
Související články[editovat | editovat zdroj]
- Bartoliova syntéza indolů
- Leimgruberova–Batchova syntéza indolů
- Madelungova syntéza indolů
- Reissertova syntéza indolů
- Gassmanova syntéza indolů
- Fischerova syntéza indolů
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Nenitzescu indole synthesis na anglické Wikipedii.
- ↑ C. D. Nenitzescu. Derivatives of 2-methyl-5-hydroxyindole. Bull. Soc. Chim. Romania. 1929, s. 37–43. DOI 10.1016/S0040-4039(01)00066-1.
- ↑ a b G. Allen; C. Pidacks. The Mitomycin Antibiotics. Synthetic Studies. Journal of the American Chemical Society. 1996-06-05, s. 2536–2544. DOI 10.1021/ja00963a032. PMID 5941382.
- ↑ a b c Daniel M. Ketcha; L. J. Wilson. The solid-phase Nenitzescu indole synthesis. Tetrahedron Letters. 2000, s. 6253–6257. DOI 10.1016/S0040-4039(00)00697-3.
- ↑ Jie Jack Li. Name Reactions, 4th ed.. Berlin: Springer-Verlag, 2009. Dostupné online. ISBN 3642010520. S. 391–392.
- ↑ Daze Katkevica; P. Trapencieris; A. Boman; I. Kalvins; T. Lundstedt. The Nenitzescu reaction: an initial screening of experimental conditions for improvement of the yield of a model reaction. Journal of Chemometrics. 2004, s. 1883–187. DOI 10.1002/cem.863.
- ↑ The role of a Lewis acid in the Nenitzescu indole synthesis. Tetrahedron Letters. 2008-09-15, s. 7106–7109. DOI 10.1016/j.tetlet.2008.09.087.
- ↑ Yun-Sheng Huang; W. Zhang; X. Zhang; J. Wang. Manufacturing synthesis of 5-hydroxy-2-methyl-1H-indole. Research on Chemical Intermediates. 2010, s. 975–983. DOI 10.1007/s11164-010-0210-x.
- ↑ Douglass F. Taber; P. K. Tirunahari. Indole synthesis: a review and proposed classification. Tetrahedron. 2011-06-21, s. 7195–7210. DOI 10.1016/j.tet.2011.06.040. PMID 25484459.
